Meglátni a molekulákat - Kémiai Nobel díj 2014


A kémiai Nobel díjat 2014-ben, mint oly sokszor az utóbbi időben, olyan felfedezésekért ítélték oda, amelyek tulajdonképpen a biológusok életét könnyítik meg. A "szuperfelbontású mikroszkópok" segítségével olyan mélyésgben ismerhetjük meg az élő sejtek működését, amely korábban fizikailag lehetetlennek tűnt és ennek a dolognak már szinte csak mellékes, esztétikai hozadéka, hogy közben gyönyörű képek születnek.
Hogy miként sikerült korábban áthatolhatatlannak tűnő 200-300 nm-es felbontási határt áttörni, az minden csak nem triviális, épp ezért én is inkább megkértem Matkó Jánost, az ELTE Immunológiai Tanszékének professzorát, hogy foglalja össze, mi is az amit Stefan Hell, illetve Eric Betzig és William Moerner az asztalra tettek, így alább az ő tolmácsolásába olvashatjátok miről is van szó:
E megosztott Nobel-díj történetét és lényegét egyetlen mondatban talán úgy lehetne összefoglalni: „Az első komoly lépések a molekulák világának láthatóvá tétele felé”.
Erre a biológusok már igen régen vártak, mivel Ernst Abbe Carl Zeiss-el együtt megfogalmazott és könyörtelen logikán alapuló egyenlete:

(ahol d a legkisebb optikai mikroszkóppal feloldható távolság két pont között, lambda a megvilágító fény hullámhossza, n a tárgy (pl. biológiai minta) és az objektív felszíne között elhelyezkedő közeg törésmutatója és alfa az alkalmazott objektív félnyílásszöge) már 1877 óta abban a hitben tartott bennünket, hogy ezt a komoly fizikai tételt csak egy alapvetően eltérő jellegű, az optikai leképezést (pl. objektívet és a fényhullámok diffrakcióját) nélkülöző módszerrel lehet „kikerülni”. Ez a törvény ugyanis azt jelenti, hogy az emberi szem számára is látható hullámhossz tartományban (kb. 450-650 nm) az optikai mikroszkópia egymástól legalább 200-300 nm távolságra levő pontokat képes két különálló pontként leképezni.
A mai modern digitális alapú mikroszkópiában ez sajnos azt is jelenti, hogy a képek technikai minősége tökéletes és digitális formában tárolható, viszont a biológiában nem jutunk el a molekulák szintjéig, hiszen ez a mérettartomány/feloldás legfeljebb a sejtszervecskék tökéletes elkülönítésére alkalmas. Az elektronmikroszkópia jobb feloldása mögött pedig ismert technikai nehézségek rejlenek, mint pl. a minta előkészítése során fellépő tortúrája, ami tulajdonképpen „egy elgyötört holdbéli táj nanotérképének” felel meg. Tehát hosszú évek óta komoly igény egyrészt hogy a tudományos igényű képalkotás elmozduljon az „élő sejtes körülmények” és a „nagyobb, molekuláris szintű térbeli feloldás” irányába. 2014 Kémiai Nobel díjasai ezen probléma megoldását tűzték ki célul maguk elé már több mint egy évtizeddel ezelőtt és különböző utakon haladva, de mindvégig példamutatóan szorosan együttműködve jutottak el azon megoldásokig, melyek ma már több kutatóhelyen is elérhetőek, és együttesen a „szuperfeloldású mikroszkópiák” nevet viselik.
Nyilván sokakban felmerül a kérdés, hogy két igen elmélyült fizikus (optikus) kutató (Betzig és Hell) és egy fizikai-kémia területén kiemelkedő kutató (Moerner) hogyan jutott éppen a kémiai Nobel-díj jelöltek listájára. Nos, a magyarázat részben abban rejlik, hogy igen sok alapvetően kémiai/fotokémiai megoldás-motívum rejlik azokban a „trükkökben”, amivel ők ki tudták kerülni a diffrakciós leképezés elvi feloldási korlátait (Abbe egyenlet). Azaz megoldották azt a célkitűzést, hogy valójában a klasszikus optikai mikroszkópok felépítését megtartva elérjék azt, hogy a diffrakciós leképezés során a tárgypontokról nyert képpontok „méretét lecsökkentsék” és ily módon javítsák a térbeli feloldást a 40-80 nm tartományba, ami a biológia világában egy jelentős áttörést jelent, hiszen ily módon „behatolhatunk” a molekuláris méretek tartományába, amit eddig sohasem láthattunk. Ez a biológiai kutatások számára ténylegesen egy új szakaszt jelenthet, hiszen akár egyedi molekulák pozíciójának, kölcsönhatásainak, mozgásainak stb. leképezésére is lehetőség nyílik.
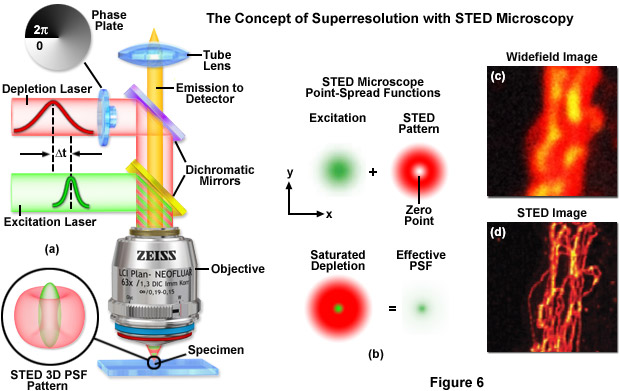
Ezeket a „szuperfeloldású” mikroszkópiákat közelebbről megvizsgálva, a megoldások logikája közös: a pontszerű fényforrásként tekinthető tárgypont (pl. fluoreszcensen jelzett biológiai molekula egy sejtben) leképezésekor keletkező képterület („pont-szétterülési függvény, PSF) csökkentése a cél. Így csökkenthető ugyanis a még feloldható legkisebb távolság (d). A STED (STimulated Emission Depletion) mikroszkópia zseniális elvének kitalálásakor Stefan Hell pl. egy a mintát megvilágító lézerrel azonos optikai tengelybe igazított segéd lézert alkalmazott a pontszerű fényforrásként tekinthető fluoreszcens molekula fluoreszcens (gerjesztett) állapotának részleges „elnéptelenítésére”, azaz a PSF méretének csökkentésére, ami a d távolság 250 nm-ről kb. 50 nm-re való csökkenését eredményezte, a STED lézer teljesítménysűrűségének függvényében. A komoly fotofizikai tanulmányokat igénylő fejlesztés során megalkották az első működő „STED-mikroszkópot”, mely azóta már kereskedelmi forgalomban is elérhető, mely tény bizonyára jelentősen fellendíti majd az orvostudományi/biológiai kutatásokat. Fizikailag, az Abbe egyenlet Stefan Hell és munkatársai munkásságának köszönhetően úgy módosul, hogy:
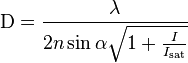
(ahol I a maximális fokális STED lézer intenzitás, Is pedig az a jellegzetes intenzitás érték ahol a fluoreszcencia valószínűsége e-ad részére csökken). Ez egyben azt is jelenti hogy a felbontásnak az optika továbbá nem szab határt, hanem csak a STED körülmények (ld. alábbi ábrát) paneljét).
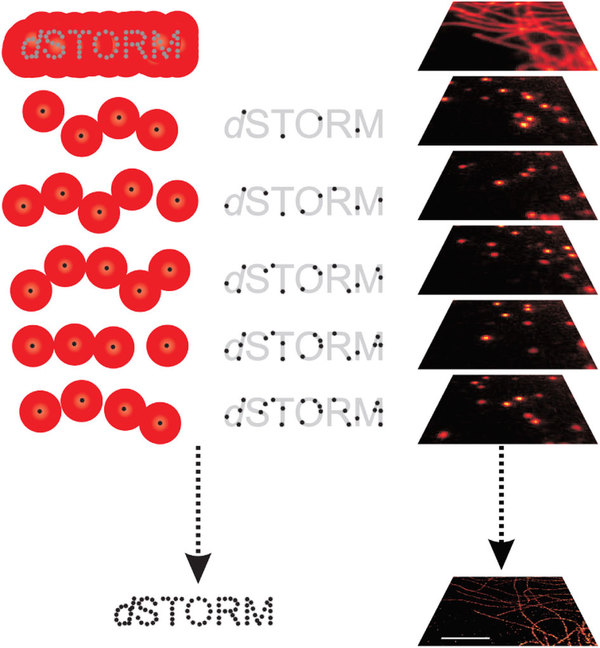
A másik, merőben eltérő megközelítés az a fluoreszcensen jelölt molekulák, beleértve az intracelluláris GFP-konstrukciókat is, pozíciójának pontos meghatározására irányul. Ennek legnagyobb akadálya a magas háttérzaj, ami a jelölt molekulák magas térbeli sűrűségéből származik. Így, Betzig és munkatársai először is megterveztek és előállítottak fotoaktiválható fluoreszcens fehérjéket (PA-FP), melyek segítségével lézerrel történő fotohalványítás és/vagy a PA-FP felvillanása és elsötétedése (blinking=villogás) során elérhető az, hogy a jelzett molekulák detektálási denzitása csökken, így pozíciójuk akár néhány nanométer precizitással detektálható lesz (mindez persze esetenként több száz egymás utáni pillanatfelvételt és statisztikai értékelést igényel). Ezt tulajdonképpen az teszi lehetővé, hogy egy egyedi fluorofór molekulából akár 104 db foton kilépését is lehet detektálni mielőtt elhalványodik. Az „egy molekula pozíció” ezen úton történő meghatározására alapozva fejlesztették ki Betzig és munkatársai pl. a „fotoaktivációs lokalizációs mikroszkópiát” (PALM), melynek komoly kémiai hátterét adta pl. a Moerner labor a PA-FP fejlesztések révén. Ez a megközelítés, hasonlóan a STED mikroszkópiához tehát az „egy molekula detektálás” és a „szuperfeoldásos mikroszkópia” fejlesztése irányában egy igen jelentős előrelépésnek számított. A megközelítési elv még egy másik mikroszkópiás módszer kifejlesztésében is jelentős szerepet játszott elsősorban a „villogó/blinking” fluorofórok jóvoltából, amelyet „Stochasztikus Optikai Rekonstrukciós Mikroszkópia” (STORM) néven ismertünk meg. Ez a módszer is azon alapul, hogy a fotoaktiválható („fotonnal ki- és be-kapcsolható”) fluorofórok elegendő mennyiségű fotont bocsátanak ki a be- és kikapcsolásuk között eletelt idő alatt, hogy ez alatt a képalkotást többször megismételve a PSF pozíciója nagy pontossággal (~ nm) meghatározható legyen.
Kommentek
Közösségünk messze túlnyomó többségének jószándéka és minden moderációs igyekezetünk ellenére cikkeink alatt időről-időre a kollégáinkat durván sértő, bántó megjegyzések jelentek meg.
Hosszas mérlegelés és a lehetőségeink alapos vizsgálata után úgy döntöttünk, hogy a jövőben a közösségépítés más útjait támogatjuk, és a cikkek alatti kommentelés lehetőségét megszüntetjük. Közösség és Belső kör csomaggal rendelkező előfizetőinket továbbra is várjuk zárt Facebook csoportunkba, a Közértbe, ahol hozzászólhatnak a cikkeinkhez, és kérdezhetnek a szerzőinktől is.