Nem csak egyedek, de egész fajok genomját átírhatjuk
Nagyon sokan félnek attól, hogy a legújabb genomszerkesztési technológiákkal visszafordíthatatlan változások jönnek az emberi örökítő anyagban.
Ez ugyan nem alaptalan, de van ennél sokkal közelebbi, közvetlenebb kockázat.
Ugyanazok a technológiák, amik az emberi dns szerkesztését lehetővé teszik, a különböző kártevők, patogének visszaszorítására még könnyebben, még hamarabb felhasználhatók. De bármilyen vonzó is lenne mondjuk a maláriát terjesztő szúnyogok végleges eltüntetése, ennek ma beláthatatlan következményei lehetnek.
Nehéz tudományos, és társadalmi viták jönnek arról, hogy százezrek életének megmentése elég fontos cél-e, amiért megéri visszfordíthatatlanul megváltoztatni a környezetet.
A genomszerkesztéshez használt felhasznált jelenség, az ún. „gene drive” annyira újszerű, hogy megfelelő magyar kifejezésünk sincs igazából rá (talán a géntámadás, vagy génkampány írja le, miről van szó, lásd alább).
Pedig időszerű lenne, hogy mi magunk is megismerkedjünk a kifejezés jelentésével, mert valószínű, hogy a közeljövőben közvetlen a geomérnökség (geoengineering) mellett ez lesz az egyik leggyarabban előrángatott ötlet, ha ökoszisztéma szintű, tervezett módosítást akarunk csinálni. A különbség az, hogy a kettő közül egyelőre a geomérnökségnek van kevesebb realitása...
A gene-drive alapgondolata, hogy olyan mesterséges, gyorsan terjedő DNS-darabot csinálunk, amely aktívan terjedve pár generáció alatt adott élőlény teljes populációjában jelen lesz. Ez nagyon különbözik attól, ahogy egy-egy új gén-variáns a természetben, a mendeli szabályokat követve terjedne: ilyen öröklődés esetében (ha csak nincs valami hatalmas szaporodási előny, amit a gén nyújt), mindig csak az utódok kb. 50%-ban lesz jelen az új allél (mert ha alapból csak az egyik szülői kromoszómán van jelen, akkor csak az ivarsejtek felében jelenhet meg). Ez persze azt is jelenti, hogy sok-sok generáció (illetve némi szerencse) kell, amíg a populációban, illetve fajban igazán mérhető mértékben lesz jelen. A "gene drive" jellegzetes tulajdonsága, hogy aktívan terjeszti önmagát, vagyis ha már rajta van az egyik szülői kromoszómán, akkor átmásolja magát a másik szülői kromoszóma megfelelő régiójába, így gyakorlatilag az összes ivarsejtben jelen lehet (kicsit úgy működik, mint egy "ugráló gén", egy transzpozon, csak célzottabb a terjedése).
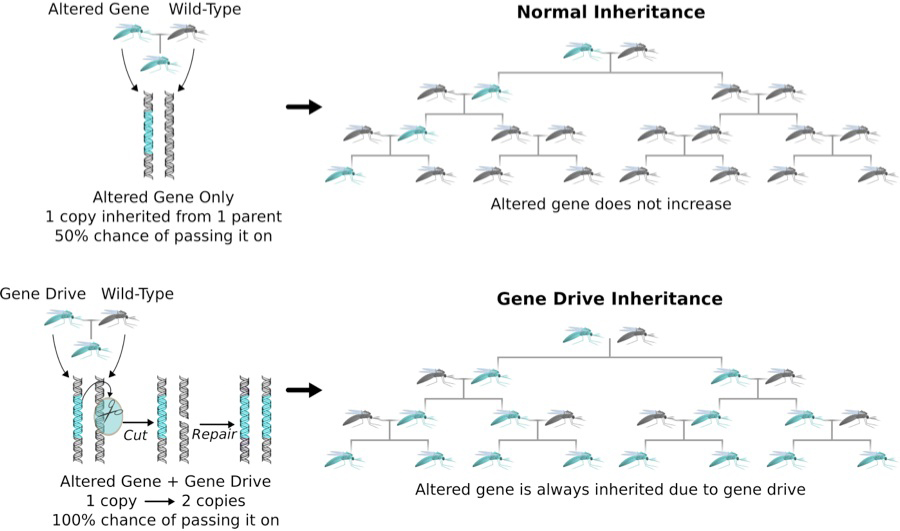
És ami nem elhanyagolandó: a gene drive-ok révén nem csak elrontani lehet géneket (bár, mint látni fogjuk, az is egy fontos tényező lehet), de akár új géneket is villámgyorsan el tudunk a populációban terjeszteni, hiszen ha a drive tartalmaz egy új jelleget kódoló DNS darabot, azt is magával viszi másoláskor (azért ez a "villámgyors" persze relatív és nagyban függ az életciklus hosszától - emberre például sosem lehetne praktikusan alkalmazni ezt a technológiát).
Ez a fajta populáció-szintű génmódosítás már évtizedek óta létezett elméleti lehetőségként (az első felvetés 1968-ból származik), sőt, ismerünk természetes gene drive példákat is, de a genomszerkesztést, a DNS szinte tetszőleges pozícióban történő elvágását hihetetlenül megkönnyítő CRISPR rendszernek köszönhetően hirtelen nagyon valósággá vált: elég ha egy olyan rendszert viszünk be, amivel adott helyen elvágjuk a kromoszómát, mert a sejt hibajavító mechanizmusai a homológ kromoszóma megfelelő régió alapján javítják ki. És ha ez a homológ régió történetesen tartalmazza a targetáláshoz szükséges szekvenciákat, máris egy önterjesztő rendszert hoztunk létre.
Az első működő, szintetikus gene drive-ot idén tavasszal, egy Science cikkben írták le, akkor még csak a genetikusok egyik "háziállatában", az ecetmuslicában, de az eredmények nem sok kétséget hagytak afelől, hogy a rendszer működőképes lesz más fajokban is. (Olyannyira, hogy pár hónappal később egy több pontból álló szempontrendszert tettek közzé ugyancsak a Science-ben kutatók, amit szem előtt kellene tartani, nehogy véletlenül egy kísérleti gene drive a karanténból kiszabadulva a természetben élő állatokba is akaratlanul bejuttassa a gene drive genetikai anyagát.)
A fent említett muslica példa esetében egy X kromoszómához kötött, a test pigmentációját szabályozó génbe építették bele a gene drive kazettát (ami terjedésekor így mindig elrontotta ezt a yellow-nak nevezett gént), és azt figyelhették meg, hogy egy hordozó hím és egy nem hordozó nőstény lányutódjainak közel 100%-a a mutánsokra jellemző színezetet mutatott (miközben a mendeli öröklésmenetben ez 0% lett volna...).
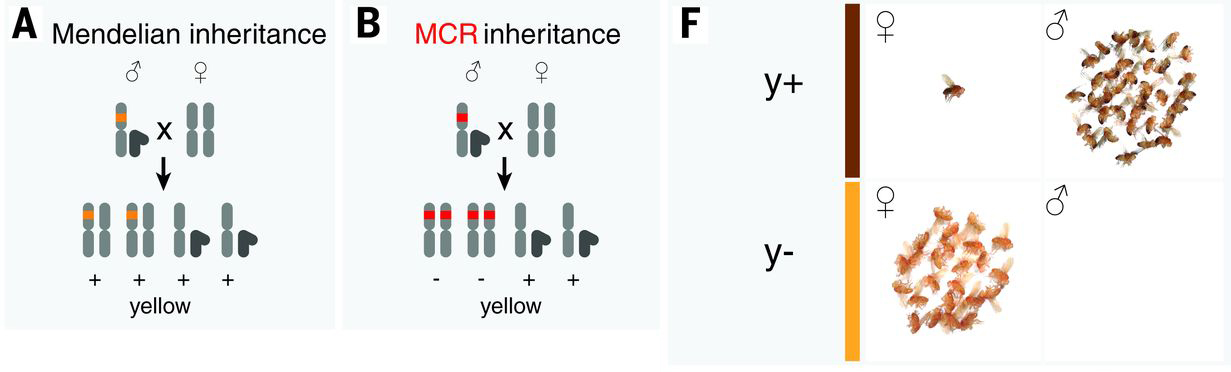
A gene drive-ok elsődleges célpontjai azonban egyáltalán nem a klasszikus modellállatok lennének, hanem a kártevők, invazív fajok és patogének, illetve az utóbbiakat hordozó, köztesgazdaként működő élőlények (ezért például kifejezetten gyakran emlegetett malária-szúnyog párosítás).
Ugyan a közelmúltban a rovarirtóval kezelt hálók, valamint a hatásosabb malária-ellenes szereknek köszönhetően drasztikusan csökkent a maláriában megbetegedők (és a betegségbe belehalók) száma, a betegség még napjainkban is közel 450 ezer halálos áldozatot szed évente. Így érthető, ha sokan igen fontosnak tekintik a teljes (vagy szinte teljes) eradikációját. És erre a gene-drive technológia segítségével, úgy tűnik, tényleg esélyünk nyílhat.
A közelmúltban két megközelítés is világot látott és mind a kettő működöképes lehet. Pár hete jelent meg a Proceedings of the National Academy of Sciences (PNAS) folyóiratban az egyik kutatás leírása, ahol olyan ellenanyagokat termeltettek egy szúnyogspecifikus gene drive segítségével, amely meggátolta a malária kórokozójának a szúnyogon belüli életbenmaradását. Ez a szúnyog életbenmaradását nem befolyásolja, és mindaddig, amíg a kórokozó nem fejleszt ki rezisztenciát (a két ellenanyag ellen egyszerre ez ha nem is lehetetlen, de nagyon nehéz), hatásos lehet a malária életciklusának megakasztásában.
Egy másik lehetőség sokkal drasztikusabb: a Nature Biotechnology honlapjára napokban felkerült cikkben egy olyan gene drive kerül bemutatásra, amely a nőstény szúnyogok sterilitását okozza, és így rövid úton a szúnyogpopuláció összeomlásához vezet.
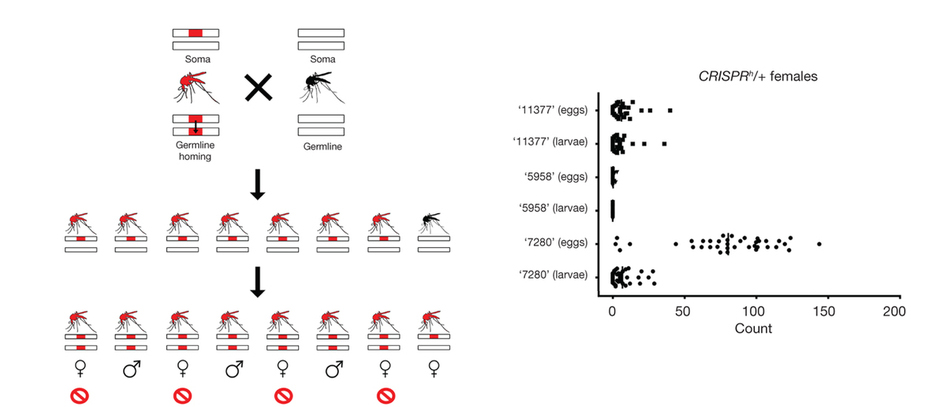
És ugyan épp ez az, amit sokan szeretnének (hiszen szúnyog nélkül a maláriát okozó Plasmodium fajok sem élnek meg), közel sem biztos, hogy annyira következmény nélküli lenne, mint azt gondoljuk. A szúnyoglárvák ugyanis fontos elemei a táplálékláncnak, fő táplálékforrását jelentik számos hal- és kétéltűfajnak, a kifejlett egyedeket pedig madarak fogyasztják előszeretettel. Mi lenne ezekkel a fajokkal, mi történne a táplálékpiramissal, ha kihúznánk az egyik alapkövét? Az igazság az, hogy nem tudjuk, de benne van a pakliban, hogy lényeges változások következhetnek be. Természetesen dönthetünk úgy, hogy az évi közel félmillió emberi élet ér ennyit, de ezt mindenképpen szakmai (és társadalmi) vita kellene megelőzze.
Mivel nálunk a malária problémája egyelőre nem akut (persze a klímaváltozással ez is változhat), a technológia sokkal kézenfekvőbb alkalmazása a kullancsok és a Lyme-kór esetében lenne. Ezzel kapcsolatban Földvári Gábor, a Szt. István Egyetem kullancs-kutatója, azon a véleményen van, hogy ha még sikerülne is bebizonyítani, hogy szúnyogokra a természetben is működőképes a dolog, a kullancsokra aligha lenne megvalósítható. A fő gond szerinte az, hogy egy kullancs populáció egyedei adott időben három fejlődési alakjukban fordulhatnak elő, ráadásul lehetnek a gazdáikon, vagy az aljnövényzetben és az avarban, ahol életük 99%-át töltik. Itt viszont foltszerűen és gyakorlatilag random módon vannak jelen, ami közel lehetetlenné teszi a populáció teljes elérését. A következő gond (és nagy különbség a szúnyogokhoz képest), hogy a közönséges kullancsnak átlagosan 4-5 év az életciklusa, de akár 8 év is lehet. Tehát még egy ideális esetben is, amikor valahogy sikerülne óriási mennyiségben kijuttatni a gene-drive-olt kullancsokat, továbbra is még sok éven át menne tovább a populációban már jelen levő, gene driveot nem hordozó lárvák, nimfák és kifejlett egyedek táplálkozása, fejlődése és szaporodása, vagyis a kórokozó terjesztése közel zavartalanul. Magyarán az időskála kullancs esetében a gene drive ellen dolgozik.
Abban a teoretikus esetben, amennyiben sikerülne kipusztítani egy élőhelyről a kullancsokat, nem tudjuk, hogy milyen ökológiai következmények lennének. Biztos, hogy eltűnne a bennük szaporodni képes fürkészdarázs és nem táplálkozhatnának velük a madarak gyíkok és emlősök (bár ezek közül egyiknek sem fő tápláléka a kullancs). A nagy távolságokat megtenni képes gerinces gazdák segítségével azonban a kullancsok jó eséllyel hamar újra elszaporodnának.
A jól működő gene drive esetleges ökológiai mellékhatásai mellett azonban léteznek más okok, ami miatt még sokan ódzkodnak, hogy egy CRISPR-alapú gene drive-ot szabadon engedjünk. Ugyanis attól a pillanattól kezdve, hogy kikerült, a gene drive kódolásáért felelős szekvencia maga is a mutációk és a szelekció "játékszere" lesz. És az csak az egyik dolog, hogy esetleg elromlik a célszekvencia, vagy a hasítást végző Cas9 fehérje szekvenciája (ami következtében a gen drive befullad, működésképtelen lesz). De a "célzást" végző RNS-t kódoló régió is összeszedhet olyan mutációkat, amelyek következtében rossz helyre ékelődik be. Ugyan ez például egy populáció-összeomlasztásra kitalált drive esetében nem okozna nagy gondot, de más esetben igen.
Nem véletlen, hogy még tavaly, az első sikeres kísérletek publikálása előtt, de amikor már lehetett sejteni, hogy azok a spájzban vannak, egy hosszú-hosszú cikk jelent meg az eLife című szaklapban, ahol a mellett, hogy felmérték mire is használhatnánk ezt a technológiát, arról is hosszasan elmélkedtek, hogy miként lehetne minél biztonságosabbá tenni.
Az egyik lehetőség, hogy például egy invazív faj visszaszorítására kitalált gene drive olyan populáció-specifikus szekvenciákat használna, ami csak az állatok invazív csoportjaiban vannak jelen, de az eredeti "őshonos" területeken élőkben nem (itt jön képbe a korábban emlegetett célzó-RNS mutációs potenciáljának problémája: mi lesz, ha az úgy változik, hogy már nem csak a cél-populációt ismeri fel?). Egy másik fontos lehetőség, hogy egy "immunizáló" gene drive-ot is elindítunk, ami vagy csak annyit csinál, hogy megváltoztatja a másik gene drive célszekvenciáját, így az nem tud terjedni (de az életképességet nem befolyásolja), vagy adott esetben visszacsinálja azt, amit az előző drive elrontott.
Ez utóbbira jó és működő példa jelent meg a napokban a Nature Biotechnology-ban, az eLife cikket is jegyző George Church csoportjától:a kísérleteikhez a gyorsan növesztehető élesztőt használták, amivel bebizonyították, hogy az egyik gén funkciója egy "ellen"-genedrive segítségével ugyanolyan hamar visszaállítható, mint ahogy elromlott.
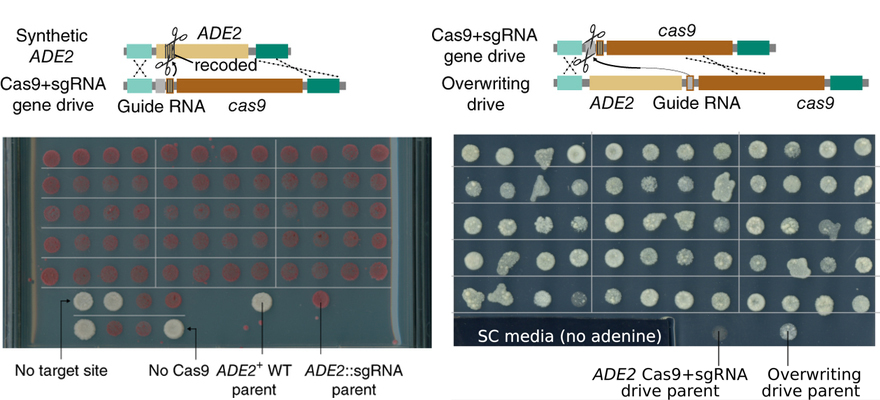
Ami visszavisz egy kicsit oda, ahonnan kiindultunk: egyelőre úgy tűnik, hogy nem az a kérdés, hogy alkalmazunk-e gene drive technológiát a közeljövőben, hanem hogy mire használjuk és elég biztonságos lesz-e a drive, amit kiviszünk a szabadba...

