Elkezdődött a rákellenes génterápiák kora
- Link másolása
- X (Twitter)
- Tumblr
Augusztus 30-án az amerikai Élelmiszer- és Gyógyszerbiztonsági Hivatal (FDA) bejelentette, hogy engedélyezi a Novartis-nak, hogy kereskedelmi forgalomba hozza KymriahTM fedőnevű tumorellenes készítményét és ezzel tulajdonképpen sok évtizednyi álmodozás után hivatalosan is elkezdődhet a rákellenes génterápia klinikai rutinalkalmazása.
A KymriahTM (korábbi, kevésbé jólcsengő nevén CTL019) a legújabb generációs, kimérikus T-sejt receptorokon (CAR-T) - hogy ezek pontosan micsodák, mindjárt bővebben is - alapuló immunterápiás készítmény, amely előállítása egyelőre elég körülményes, ugyanakkor hatása eddig kifejezetten lenyűgöző. Nem msáról van szó, mint az utóbbi évek egyik legígéretesebb módszerének az ún. rákellenes immunterápiának egy gyakorlati alkalmazásáról, amelynek a lényege, hogy a daganatos sejtekre ható gyógyszerek helyett a szervezet saját immunrendszerét ruházzák fel olyan képességgel, hogy képes legyen felismerni és elpusztítani a rákos sejteket.
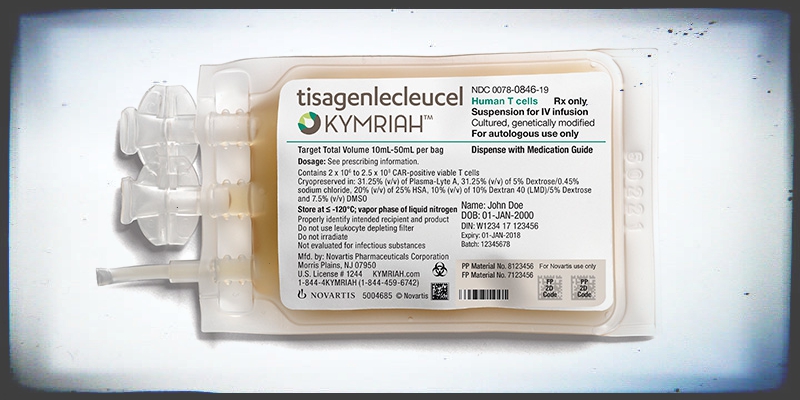
Hogy is történik mindez. Első lépésben a beteg saját immunsejtjeit (fehérvérsejtjeit) izolálják vérből egy leukofarézis nevű folyamat során, amelynek a végén feldúsítják az ún. T-sejteket, azokat az immunsejtjeinket, amelyek funkciója egyébként is a beteg (akár daganatos, akár vírussal fertőzött) sejtek megtalálása és elpusztítása. Számos daganat azonban ki tudja őket cselezni azzal, hogy a sejtjei "láthatatlanná" válnak a sejtfelszíneken levő fehérjéket letapogató T-sejtek számára, emiatt nem képes a szervezet minden esetben megbírkózni a daganatokkal. Ugyanakkor, ha egy kicsit rásegítünk a dologra és bevisszük a T-sejtbe azokat a receptorokat, amelyek segítségével képesek lesznek felfedezni a daganat sejtjeit, akkor onnan kezdve ismét hatékony rendfertartóként működnek (hogy felidézzük az Egyszer volt ... az élet klasszikus hasonlatát).
És itt jönnek képbe a már emlegetett CAR-T receptorok, ugyanis ezek azok a molekulák, amelyek kulcsszerepet játsznak be a rásegítésben. Olyan fehérjékről van szó, amelyeknek a sejten kívüli része képes a rákos sejtre jellemző egyik fehérjét felismerni, sejten belüli komponensei pedig azt biztosítják, hogy ha ez a felismerés megtörténik, akkor a T-sejt bepöccenjen és elpusztítsa másik sejtet. Így ha ezeket a kiméra receptor-molekulákat sikeresen bevisszük az izolált T-sejtekbe és azokat felszaporítjuk, majd visszaültetjük a betegbe, nincs más dolgunk mint várni.
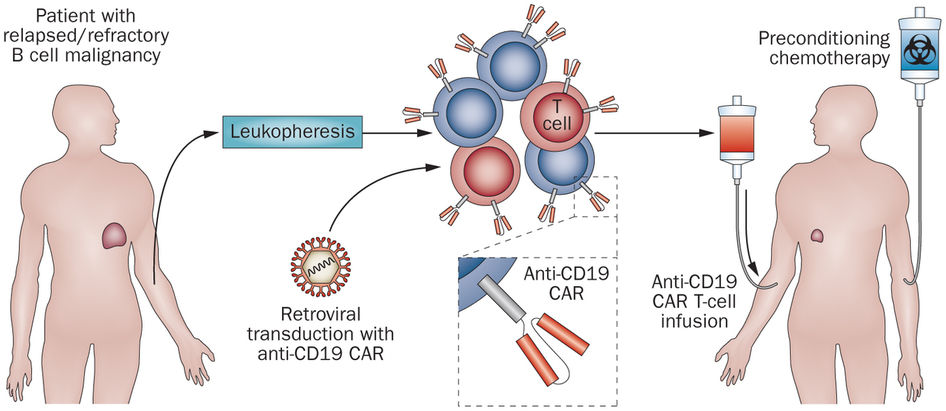
A várakozás márpedig többnyire eredményes: a Novartis klinikai kísérletében konkrétan 63 betegből 52-ben húzódott vissza a rák, ami korábban példátlan, 83%-os hatásosságot jelent. Ugyanakkor a bonyolult procedúra nem teszi éppen olcsóvá a dolgot: egy-egy kezelés árát a svájci gyógyszercég 475 ezer dollárban (vagyis uszkve 122 millió forintban) határozta meg. Hogy ez pont elég, vagy már kissé borsos, arról megoszlanak a vélemények. (Megj: bővebben immunterápiáról és hogy miképp is működnek a T-sejtek, itt olvashattok.)
Ami még fontos, de talán kevésbé jön le több hurráoptimista híradásból, az az, hogy ez a fajta terápia egyelőre koránt sem tekinthető általános rákterápiának (bár a remény természetesen az, hogy egyszer majd azzá válhat). A KymriahTM konkrétan csak a fehérvérűség különleges fajtáira, a B-sejtes limfómákra használható. Ezek olyan agresszív rákos elváltozások, amikor a szervezet immunsejtjeinek egy másik csoportja, a B-sejtek kezdenek agresszív, gát nélküli osztódásba. Igazából jó terápiájuk ezeknek a megbetegedéseknek nincs, szinte mindig hallál jár a kialakulásuk. A Novartis terápiájában egy olyan kiméra receptort jutattnak a T-sejtekbe, amely a B-sejtekre jellemző, CD19 nevű sejtfelszíni fehérjét képes felismerni, ezáltal végül az immunrendszer önmagát teszi rendbe - igaz, ennek azért ára van. Ugyanis a CD19 nemcsak a rosszindulatú B-sejteken fejeződik majd ki, hanem mindegyik B-sejten, de a CAR-T sejtek nem tudnak különbséget tenni, így a betegeknek az összes B-sejtjét megtámadják és elpusztítják, enyhe immundeficienciát, B-sejtes apláziát okozva. Ez azonban még mindig kevésbé súlyos tünet, mint a limfóma, így ez egy olyan trade-off, ami mindenki szerint megéri.
A specificitás hiánya azonban természetesen más CAR-T terápiákra is vonatkozhat, hacsak nincsenek kizárólag a tumorra jellemző sejtfelszíni molekulák (és általában nincsenek, ill. körülményes rájuk receptort találni), vagyis elég aktív kutatás-tárgya, hogy miképp lehetne csak a daganat sejtjeit célozni. Az egyik ígéretes megoldás, hogy nem egyetlen sejtfelszíni molekulát, hanem molekula-párokat keresnek, mert nagyobb az esélye, hogy ezek csak a daganat sejtjein lesznek egyszerre jelen.
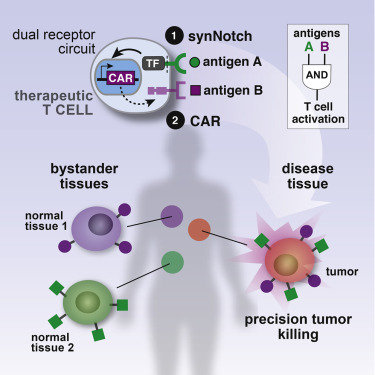
Ilyenkor persze két szintetikus receptort is be kell vinni a T-sejtekbe, amelyek egyfajta logikai ÉS kapuként működnek és együttes aktivációjuk aktiválja a T-sejtet (általában az első recpetor aktiválódása fogja a T-sejt ölőmechanizmusát aktiváló, második receptor kifejeződését és sejtfelszínre való kikerülését lehetővé tenni).
Egy másik problematikus pontja a terápiának (illetve amiért ennyire drága is egyben), hogy minden esetben a beteg saját fehérvérsejtjeinek izolálásával indul, ami miatt egyszerre időigényes is (és az idő az, ami egy agresszív limfómánál a legkevesebb van), illetve néha nem is praktikus, hiszen a betgek már adott esetben immunoszupresszív gyógyszereket szednek egy ideje (vagyis alig lenne immunsejtjük). Az ideális az lenne, ha lehetne olyan CAR-T sejteket gyártani, amelyeket bárkinek lehetne adni, így azok felszaporítva és lefagyasztva kellene várják, hogy mikor van rájuk szükség.
Mint minden transzplantációnál itt is azonban felmerülhetnek gondok: mi van, ha a szevezet idegenként ismeri fel a beültett sejteket és elpusztítja azokat?, vagy ha épp fordítva, az idegen (donor)szervezetből származó CAR-T sejt ugyan felismeri a rákos sejteket, elvégzi a feladatát, de aztán a beteg egyéb sejtjeit is idegenként ismeri fel és elkezdi azokat is támadni?, vagy mi van, ha egyszerűen az immunoszupresszív gyógyszerek miatt a CAR-T sejtek sem lesznek hatékonyak?
Ezekre a kérdésekre a klasszikus génterápia nem kínál megoldást és egészen a közelmúltig nem is látszott miképp lehetne megkerülni őket. Azonban az új genomszerkesztési eljárások elterjedésével hirtelen megnyílt az út ilyen különleges, egy kaptafára készülő CAR-T sejtek készítéséhez. A genomszerkesztő eszközökkel ugyanis ki tudjuk azokat a génjeit ütni a génterápiával egyébként is módosított T-sejteknek, amelyek pont a fenti folyamatokban fontos fehérjéket kódolják, így a szervezet immunrendszere által elfogadott, csak a rákos sejteket felismerő, gyógyszerekre kevésbé érzékeny immunsejtek jöhetnek létre.
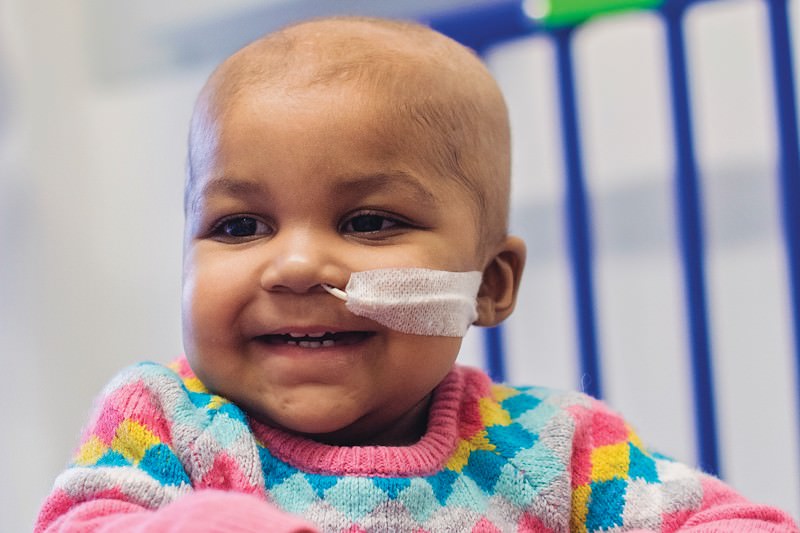
Először pár évvel ezelőtt egy londoni kórházban volt alkalom élesben ilyen sejteket kipróbálni, amikor a képen látható Layla Richards nevű kislány esetében minden más terápia csődöt mondott. A Great Ormond Street Hospital egy másik emeletén azonban pont ezeken a különleges CAR-T sejteken dolgoztak, csak épp addig emberben soha nem próbálták ki. Layla kezelőorvosa más esélyt nem látva rábeszélte kollegáit, hogy a kislányra alkalmazzák a terápiát, ami annyira jól sikerült, hogy az eset azóta is a CAR-T terápiák és a genomszerkesztés potenciáljának egyik poszteresete lett.
Kisebb megjegyzések, de azért nem hagynám ki, hogy egyelőre ezek a terápiák csak a leukémiák különböző formái ellen igazán hatékonyak, szilárd tumorok ellen még kevésbé. Illetve nem elhanyagolható dolog, hogy a kiméra receptorok bevitele olyan módosított retrovírusok segítségével történik, amelyek nem teljesen irányított módon illesztik be tartalmukat a genomba, így mindig megvan a kicsi, de valós esélye, hogy pusztán az inszercióból valami gebasz lesz - láttunk ilyent már egyéb génterápiás eljárásoknál. (És ez is az "egykaptafás" CAR-T reagensek előnye lehetne, hogy azokban pontosan jellemezni lehetne hova illesztődik be az új DNS, biztosítva, hogy az ne érjen kritikus genomi darabokat.)
Most úgy tűnik minden adott, hogy ezeké a tényleg ígéretes terápiáké legyen a közeljövő, és hogy mennyire így látja ezt a piac is, azt jól mutatja, hogy alig három napja (azaz még az FDA bejelentése előtt) vették meg a CAR-T terápiák egyik úttörőjét, a Kite Pharmát közel 12 milliárd dollárét.
(Forrás: New Scientist, STATNews. Illetve hatalmas köszönet Boross Péternek a tippekért.)
