
Így látunk bele a biomolekulák lelkébe
A 2017. évi kémiai Nobel-díjat Jacques Dubochet, Joachim Frank és Richard Henderson kapták megosztva a krio-elektronmikroszkópia kifejlesztése során elért eredményeikért. Ennek az igazából népszerűvé csak az utóbbi években váló technikának köszönhetően a bio-makromolekulák oldatbeli (azaz természtes állapotban létező) térszerkezete határozható meg nagy felbontással.
Az első elektronmikroszkópot az 1930-as években fejlesztették ki, és a munkában úttörő szerepet játszó Ernst Ruska német fizikus eredményeit 1986-ban fizikai Nobel-díjjal jutalmazták. Az elektronmikroszkóp különlegessége, hogy a minta megvilágítása elektronokkal történik. Erre azért van szükség, mert a mikroszkópok felbontását az Abbé törvény szerint a megvilágításra használt fény hullámhossza korlátozza: minél kisebb hullámhosszú elektromágneses sugárzással dolgozunk, annál nagyobb felbontás érhető el. Az optikai mikroszkóppal elméletileg elérhető legnagyobb felbontás 200-300 nm (0.0002-0.0003 mm), ami azt jelenti, hogy a mikroszkóp egymástól 200-300 nm-re lévő pontokat képes különálló pontokként leképezni. (Szerk.: lásd még posztunkat a 2014-es kémiai Nobel-díjról.) Elektronok alkalmazásával akár atomi felbontás is elérhető, tehát a képen az egyes atomok egymástól elkülönülve láthatók.
A biológiai makromolekulák, így a fehérjék és nukleinsavak (DNS és RNS) szerkezetvizsgálatának óriási jelentősége van a biológiában és az orvostudományban, hiszen például az aminosavakból felépülő, nagyméretű fehérjék, melyek a sejtek gyakorlatilag összes biológiai funkciójában szerepet játszanak. A legtöbb fehérje jól meghatározott háromdimenziós szerkezettel rendelkezik és ez a szerkezet teszi lehetővé funkcióik ellátását. Néha egy-két aminosav megváltozása a funkció teljes elvesztődéséhez, átalakulásához elég, de ennek a megértéséhez tudnunk kell(ene), hogy is néz ki az adott fehérje.
Makromolekulák térszerkezetének nagy felbontású vizsgálatára a legelterjedtebben alkalmazott módszer a röntgenkrisztallográfia. Ezzel a módszerrel a molekulák háromdimenziós szerkezete akár atomi felbontással is meghatározható, de a technika nagy hátránya, hogy a vizsgálandó molekulát kristályosítani kell. Ez makromolekulák esetén gyakran igen nehéz feladat, akár hosszú évek is eltelhetnek azzal, hogy a kristályosítás megfelelő körülményeit próbálják kidolgozni és esetenként ennek ellenére sem sikerül a dolog. Különösen fontos orvosbiológiai szempontból a sejtmembránba beágyazódó fehérjék szerkezetvizsgálata, hiszen az ismert gyógyszerhatóanyagok legalább 50%-a ilyen membránfehérjékhez kötődve fejti ki hatását. Ezek a fehérjék aztán különösen nehezen kristályosíthatók (nem véletlenül járt 2012-ben kémiai Nobel-díj membránfehérjék szerkezetvizsgálatáért).
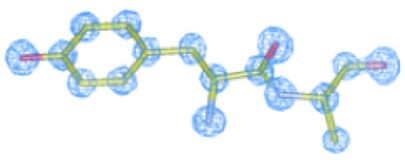
Az elektronmikroszkóp megalkotásakor úgy tűnt, hogy a technika nem lesz alkalmas biológiai minták vizsgálatára, ugyanis azok nagyon könnyen károsodnak az elektronsugárral való találkozás következtében. A membránfehérjék kristályosítása során tapasztalt kudarcok sarkallták Richard Henderson skót kutatót arra, hogy elektronmikroszkóppal próbálja meg tanulmányozni a bakteriorodopszin nevű membránfehérjét, mely Halobacteriumok fotoszintézisében játszik szerepet. A sugárzás általi károsodás csökkentése érdekében kisebb elektrondózist alkalmazott. A minta forgatása segítségével sikerült egy körülbelül 0,7 nm (0,0000007 mm) felbontású háromdimenziós képet alkotniuk a fehérjéről. Ezzel Henderson bebizonyította, hogy az elektronmikroszkópia alkalmas az érzékeny biológiai minták vizsgálatára is. Henderson azonban azt szerette volna megmutatni, hogy a technikával közel atomi felbontás is elérhető biológiai minták esetén. Az elektronmikroszkópia fejlődésének köszönhetően első eredményei után 15 évvel, 1990-ben publikálta a bakteriorodopszin elektronmikroszkóppal meghatározott, közel atomi felbontású modelljét, mely az alábbi ábrán látható:

Mivel mikroszkópok használatakor a tárgyak kétdimenziós vetületét láthatjuk, háromdimenziós képet úgy kaphatunk csak, ha például a mintát forgatjuk, s így több irányú vetületekből összerakható a térbeli kép. Egy másik megoldás, ha a minta több, különböző orientációban lévő példányát vizsgáljuk, majd az így kapott különböző vetületekből állítjuk elő a háromdimenziós képet. Ahogy láttuk, a biológiai minták érzékenysége miatt azok vizsgálatakor kis elektrondózist kell alkalmazni, ez viszonyt azt eredményezi, hogy a képen sokkal halványabban, sokszor alig észrevehetően látszanak a molekulák. Tovább bonyolítja a problémát, hogy a makromolekulák szerkezete gyakran flexibilis, így nem biztos, hogy minden vizsgált molekula pontosan ugyanazzal a térszerkezettel rendelkezik.
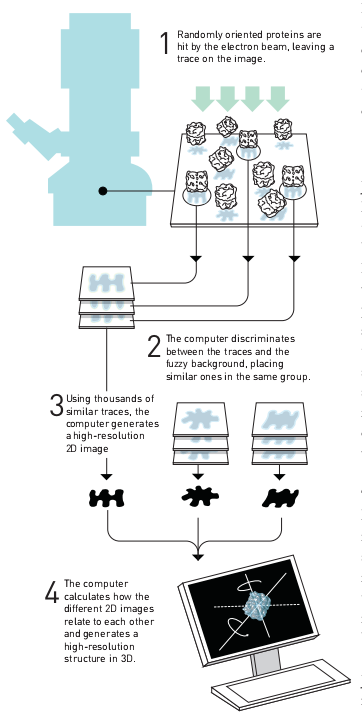
Joachim Frank és munkatársai a képfeldolgozás területén értek el átütő eredményeket. Az általuk kifejlesztett számítógépes módszerek lehetővé teszik, hogy a képeken megtalált, nehezen látható részecskéket orientáció és a háromdimenziós szerkezet szerint osztályozzuk, majd az azonos orientációban található részecskéket átlagoljuk, ezzel nagymértékben csökkentve a zaj szintjét. Mivel az osztályzás térszerkezet szerint is történik, a módszerrel információt kapunk a molekula flexibilitásáról is, ami gyakran nagy biológiai jelentőséggel bír.
Biomolekulák vizsgálatakor problémát jelent, hogy a molekulák csak vizes oldatokban rendelkeznek stabil térszerkezettel. A sugárzás káros hatásait kiküszöbölendő, célszerűnek látszana a minta lefagyasztása (ugyanis alacsony hőmérsékleten sokkal lassabban zajlanak a minta károsodását okozó reakciók is), azonban víz lassú hűtésekor jégkristályok képződnek. A jégkristályok megjelenése pedig nemcsak tönkre teheti a molekulák térszerkezetét, de a kép minőségét is rontja. Víz nagy sebességgel történő lehűtésével elérhető, hogy jégkristályok képződése nélkül ún. vitrifikált, amorf víz képződjön. Az 1980-as évekig kérdéses volt azonban, hogy a gyakorlatban elérhető -e olyan hűtési sebesség, hogy ne képződnek jégkristályok.
Ezt érték el 1981-ben Jacques Dubochet és munkatársai, akik olyan módszert mutattak be, mellyel lehetőség volt néhány mikrométer méretű vízcseppek kristályos jég képződése nélküli lefagyasztására. Ehhez a vizes oldatot egy grafitból készült rácsra viszik fel és a felesleges folyadékmennyiség felitatása után a rácsot folyékony etánba vagy propánba mártják (ez körülbelül -190 °C-os). (A mintaelőkészítés folyamata az szomszédos ábrán látható - alul egy vírus krio-elektronmikroszkópos képe van kiemelve.
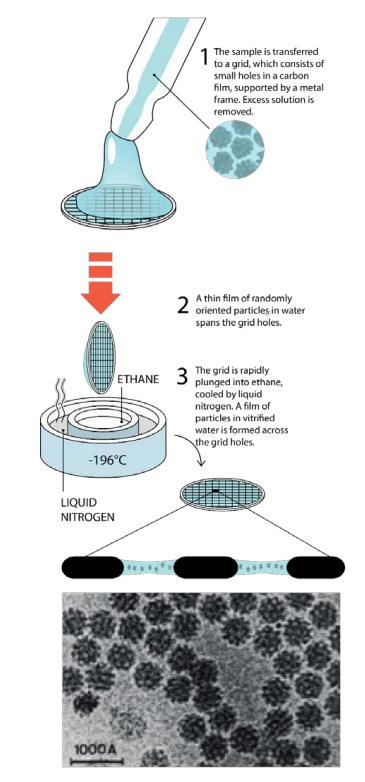
Dubochet és munkatársai megmutatták, hogy a mintaelőkészítési módszer általánosan alkalmazható biológiai minták vizsgálatára.
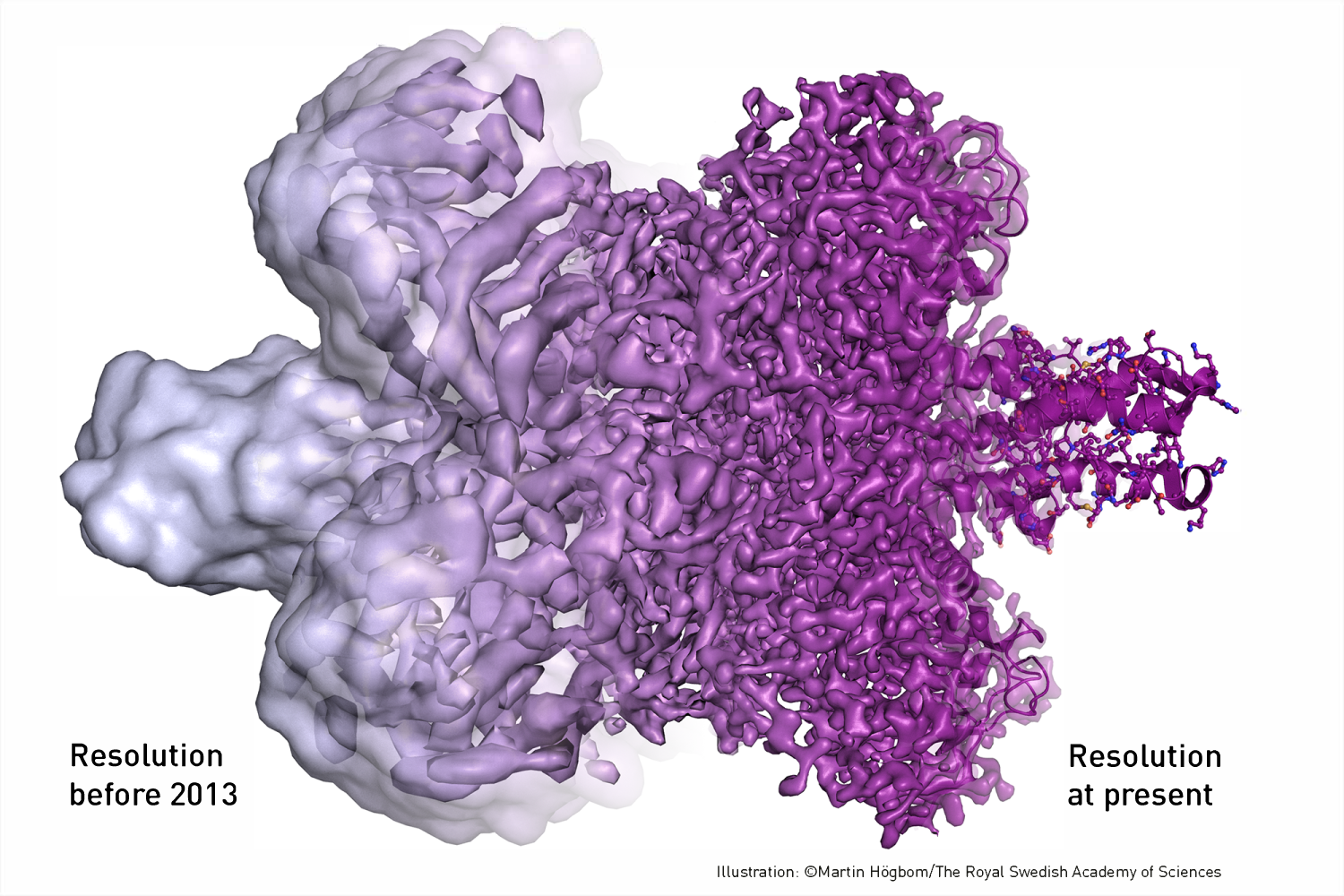
Nagyon fontos (és valószínűleg a díj odaitélésében is szerepet játszott), hogy az utóbbi években ugrásszerűen javult a krio-elektronmikroszkópiával elérhető maximális felbontás. Ennek a hatalmas fejlődésnek alapvetően három oka van: a modernebb mikroszkópok nagyobb stabilitással és jobb optikai tulajdonságokkal rendelkeznek, és a folyamatosan fejlődő szoftverek a korábbiaknál sokkal hatékonyabb képfeldolgozást tesznek lehetővé. A legfontosabb azonban az új típusú, ún. direkt elektron detektorok megjelenése, melyek alkalmazásával nagymértékben csökkenthető a zaj mértéke, illetve a nagy kiolvasási sebességnek köszönhetően lehetőség van rövid videók felvételére is (Richard Hendersonnak az új detektorok kifejlesztésében is komoly szerepe van). A vizsgált molekulák az elektronsugár hatására kis mértékben elmozdulnak, így a képeken kissé elmosódnak, viszont a videók segítségével a mozgás iránya is látható, így a feldolgozáskor ezt korrigálva élesebb képet kapunk.
(A posztot Dürvanger Zsolt, az MTA-ELTE fehérjemodellező kutatócsoport doktorandusza írta.)

Az idei kémiai Nobel-díj egyik kitüntetettje nemcsak okos, hanem vicces is
Jacques Dubochet a hivatalos életrajzában poénkodik.

Meglátni a molekulákat - Kémiai Nobel díj 2014
A 2014-es Kémiai Nobel díjat olyan technikai megoldásokért adták, amelyeknek köszönhetően lassan egyedi molekulákat is megfigyelhetünk élő sejtekben.

