Még mindig távol a dizájnerbébik kora
Bő két évvel ezelőtt, amikor az első hírek megjelentek a CRISPR-alapú genomszerkesztési eljárással módosított emberi embriókról, már látszott, hogy még nagyon sok tisztázni való akad technikailag is (hogy az etikai kérdésekről ne beszéljünk), mielőtt eljárás gyakorlati alkalmazása komolyan szóba kerülhetne. Azóta, idén márciusban egy harmadik kínai cikk is napvilágot látott, amiben már a korábbiakkal ellentétben életképes (diploid) embriók kezeléséről számoltak be, igaz, még csak néhány embrió esetében próbálkoztak sikerrel.
Épp ezért szólt nagyot, amikor bő egy hete az MIT Technology Review megszellőztette, hogy amerikai kutatók több mint száz embrión végeztek el egy nagyon alapos felmérést, és azt vizsgálták, hogy mennyire tudunk a CRISPR-rendszerrel hibákat javítani, mennyire használható kívülről bevitt DNS templátnak, a hasítás indukálta hiba kijavítjására
(Update: a közérthetőbb, nem-szakmai összefoglalóhoz ugorj a poszt végére.)
A munkát az Oregon Health and Science University (OHSU) kicsit excentrikus, kazah származású kutatója, Sukrat Mitalipov vezette, aki korábban már majmok és emberi embriók klónozásával, valamint ún. „háromszülős” emberi embriók (ahol a mitokondriális DNS egy harmadik személytől ered) létrehozásával hívta fel magára a figyelmet.
A kutatásnak tulajdonképpen két nagy része van: az egyikben nem sokkal a megtermékenyítés után, a másikban pedig a megtermékenyítés során próbálták meg a genomszerkesztést beindítani. A kutatás közvetlen célja a MYBPC3 nevű gén egy jellegzetes mutációjának kijavítása volt. Mégpedig azért pont ezt a gént választották, mert ennek a szívizomban működő génnek a meghibásodása egy elég gyakori fenotípust (kb. minden 500. felnőtt érintett), a szívkamrák falának megvastagodását okozza, ami sokáig ugyan tünetmentes lehet, de végül szívleálláshoz vezethet és fiatal sportolókban ez a váratlan elhalálozás egyik vezető oka. Ráadásul egy ún. autoszomális domináns mutációról van szó, vagyis elegendő, ha a gén sejtben levő két kópiája közül csak az egyik hibás és máris megjelenik a fenotípus.
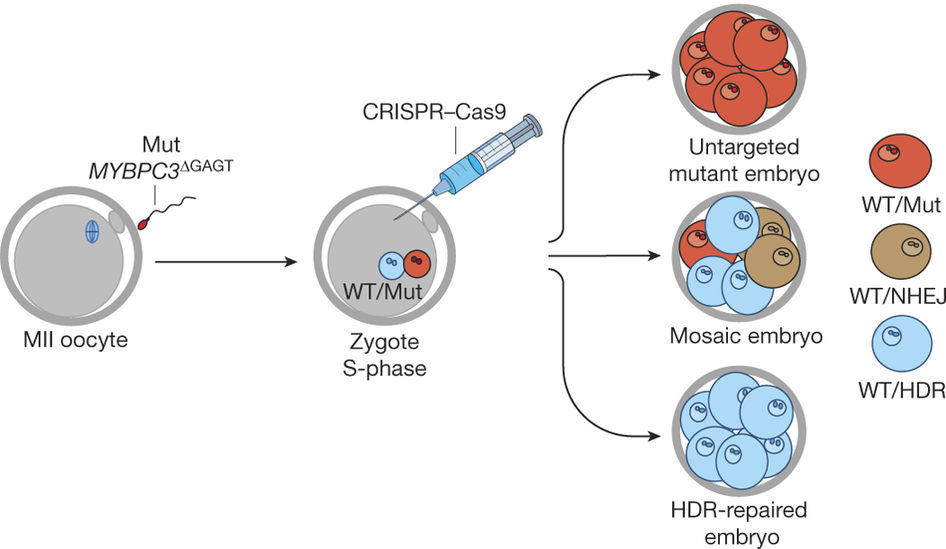
A zigóták létrehozásához egy egészséges donor anya petesejtjét termékenyítették meg IVF segítségéve egy mutációt hordozó apa spermájával, majd 4-8 sejtes állapotban minden egyes sejtben megnézték, hogy a gén milyen formái vannak jelen. Mivel az apa heterozigóta volt (vagyis egy egészséges és egy hibás verzióját hordozta a génnek), ezért kezelés nélkül a megtermékenyített embriók fele hordozó, fele vad típusú lett, attól függően, hogy a spermiumok épp a hibás kópiát hordozták, vagy sem (az ivarsejtjeink haploidok, vagyis a teljes génállományunk egyetlen kópiáját hordozzák, szemben a diploid szomatikus sejtekkel). A beavatkozás hatására, ezek az arányok azonban szignifikánsan eltolódtak: az embriók kétharmada csak a MYBPC3 egészséges kópiáit hordozta, mindössze 9.3%-uk volt „átlagos heterozigóta” (vagyis minden sejtben egy egészéges és egy mutáns allélt hordozó), a maradék közel negyede az eseteknek olyan mozaikos eloszlást mutatott, ahol egyes allélok egészségesek voltak, egyesek az eredeti mutációt hordozták, míg megint mások egy másik fajta mutációt, azt mutatva, hogy a genomszerkesztés CRISPR-diktálta hasítási lépése megtörtént, de a sejt hibajavító mechanizmusa nem a jó MYBPC3 kópiát használta fel a javításhoz (ezt a javítást nevezné a szakzsargon HDR-nek), hanem csak gyorsan össze toldotta-foldotta a DNS-t és valamifajta új mutációt vitt be. (Fontos részlet, hogy a CRISPR-rendszer csak a hibás MYBPC3 allélt vette célba, az egészségeset nem.)
Összességében ez azt jelentette, hogy tulajdonképpen a hibás embriók kevesebb mint felében ment flottul a javítás, ami nem tűnik soknak, de mégis jóval szignifikánsabb arány, mint azt a korábbi, kínai kísérletek sugallták. Sőt, ami fontosabb, hogy több sejt (blasztoméra) teljes genomjának megszekvenálásával sem leltek olyan eseteket, amikor a CRISPR rendszer a célrégión kívül vágott volna (ún. „off-target hatás”).
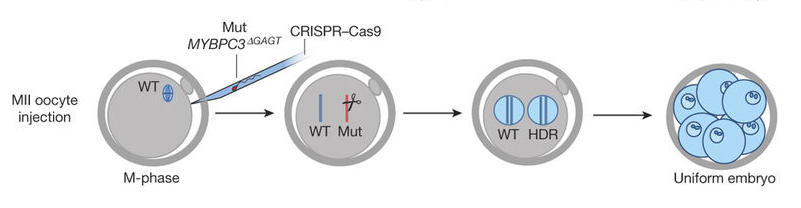
A következő kísérletben már az IVF során, a spermiumokat is tartalmazó tűben vitték be a CRISPR-reagenseket. Ebben az esetben már az utód embriók közel háromnegyede csak a helyes allélt hordozta, a maradék embriókban a helyes allél mellett pedig egy olyan mutáns volt, ami nem egyezett az eredeti mutációval (ilyenkor minden sejtben ugyanaz a mutáció volt, nem volt mozaikosság). Összeségében ez azt jelzi, hogy az apai gént minden esetben elhasította a rendszer, csak az különbözött, hogy a helyes allél állt helyre („HDR javítás”), vagy egy másfajta mutáció keletkezett a gyors DNS-toldozás („NHEJ javítás”) eredményeképpen.
Fontos érdekesség, hogy minden egyes esetben, amikor HDR javítás történt, a rendszer az anyai allélt használta fel templátnak és egyszer sem azokat a rövid oligonukleotidokat, amelyeket szintetikus templátként a kutatók vittek be. Ez azért jelentős, mert azt jelzi, hogy tulajdonképpen új tulajdonságot, új szekvenciadarabot nem tudtak bevinni - ami azt mutatja, hogy egyelőre nincs esélye annak az utópiának, hogy az embriók szekvenciáját tetszőlegesen módosítjuk (lásd még „dizájnerbébik”).
Két fontos kérdés merül fel: egyrészt, hogy miért van ez így, másrészt pedig, hogy akkor mire jó ez az egész?
Az első kérdésnél más fajok alapján lehet pár ötletünk: a CRISPR-rendszer hasítási hatékonysága ellenére számos fajban, így pl. zebrahalban is nagyon alacsony a HDR-alapú javítás hatékonysága. Ezekben az esetekben hosszabb szintetikus templátok (amelyek nagyobb részben mutatnak azonosságot a célszekvencia mutáció két oldalán levő részével) nagyobb hatékonyságot biztosítottak, illetve a bevitt templát DNS-en alkalmazott egyéb trükkökkel még tovább volt növelhető a hatékonyság. Vagyis még talán korai elkönyvelni, hogy az emberi embriók abszolút alkalmatlanok az ilyenfajta szerkesztésre, további kísérletek fogják ezt tisztázni.
A másik kérdésre pedig az a válasz, hogy ilyen autoszómális domináns mutációknál, ha nagyon hatékony a módszer, akkor a hordozó szülő biztosíthatná, hogy utódja semmiképpen ne legyen hordozó. Persze szigorúan véve ezt ma is elérhetjük az IVF során keletkező embriók genetikai jellemzésével, tehát nagy alkalmazott haszna most még nem valószínű ennek a technikailag nem épp egyszerű módszernek.
Épp ezért a szigorúan tervezett dizájnerbébik helyett, ahogy Philip Ball is rámutatott januári Guardian cikkében, az a valószínűbb jövőkép, hogy a szekvenálási költségek rohamos csökkenésével, sok-sok IVF embrió közül választhatnak a beültetésre váró párok: az embriók egy-egy sejtjének megszekvenálása révén (ebben a fázisban ennyit gond nélkül pótol az embrió), a teljes genomi szekvencia rendelkezésünkre áll majd és ez alapján bizonyos predikciókat tudunk tenni. Biztosat azonban csak néhány, súlyos betegséget okozó mutáció esetében lehet majd mondani és inkább az lesz ilyenkor a „diagnózis”, hogy a jelen levő DNS polimorfizmusok adott kombinációja alapján X% valószínűsége lehet az adott embrióból kiejlődő utód korai cukorbetegségének és Y% annak, hogy az illető felnőttként az IQ-görbe felső 40%-ban lesz. Ez nagyon nem az a determinisztikus dolog, amit sokan gondolnak, de ez a genetikai tesztek komplikált valósága, hiszen minél több genom áll rendelkezésünkre, annál inkább azt látjuk, hogy egyes polimorfizmusok következményének pontos megjóslása messze-messze nem olyan egyszerű, mint azt sokáig képzeltük.
Update: röviden arról van szó, hogy a valódi dizájner bébikhez a genom tetszőleges pontjába általunk megadott információt kellene bevigyünk. Mitalipovék kísérlete azt mutatja, hogy ennek az első fele működik, vagyis az emberi genetikai állomány tetszőleges pontját nagy pontossággal el tudjuk érni (hasítani tudjuk), de abban még egyáltalán nem vagyunk hatékonyak, hogy a sejteket rávegyük, hogy oda az átalunk megadott információt vigyék be. A kezelt embriókban egy szívizomműködésben szerepet játszó hibás gént céloztak meg, amit az embrió az apától örökölt, és azt figyelték meg, hogy a sejtek ilyenkor az adott gén anyai kópiáját felhasználva írták át a DNS-t és nem a kutatók által bevitt szekvencia alapján.