Tíz éves az optogenetika - de ismerjük-e a korlátait?
____simple_html_dom__voku__html_wrapper____>
A Fény Ünnepe, a Fény Évében - keresve se találhatnánk jobb időpontot, hogy egy kicsit az elmúlt évek egy másik nagy biológiai forradalmával, az optogenetikával foglalkozzunk.
Az emberek esetében a külvilágból érkező ingerek elsöprő többsége vizuális, vagyis a fénnyel és látással kapcsolatos, de az élőlények többsége így-vagy úgy érzékelik a fényt. Ehhez különböző szervezetek különböző fényérzékeny fehérjéket használnak, olyan molekulákat, amelyek egy-egy fotont elnyelve alakváltozáson mennek át, ami befolyásolja a működésüket. Számunkra talána legkézenfekvőbb, ha a szemünkben található rhodopszin és opszin molekulákra gondolunk, de ilyen fényaktivált receptorokon kívül találunk számos fényérzékeny fehérje-fehérje interakciót a növényekben (amelyek a napszakok és az évszakok változását, illetve a fény irányát követik ezek segítségével), illetve fényre aktiválódó ioncsatornákat algákban és baktériumokban. Ez utóbbiak lettek épp egy évtizede az "optogenetika" forradalmának zászlóvivői (habár ma már más fényérzékeny rendszereket is használunk ugyanezen címszó alatt).
A különböző hullámhosszú fénnyel aktiválható ioncsatornák azért válhattak ennyire népszerűvé, mert lehetővé teszik az idegsejtek eddig elérhetetlenül finom felbontású befolyásolását, s ezáltal olyan szinten tudjuk az idegrendszer működését vizsgálni, mint arra korábban nem volt lehetőség.
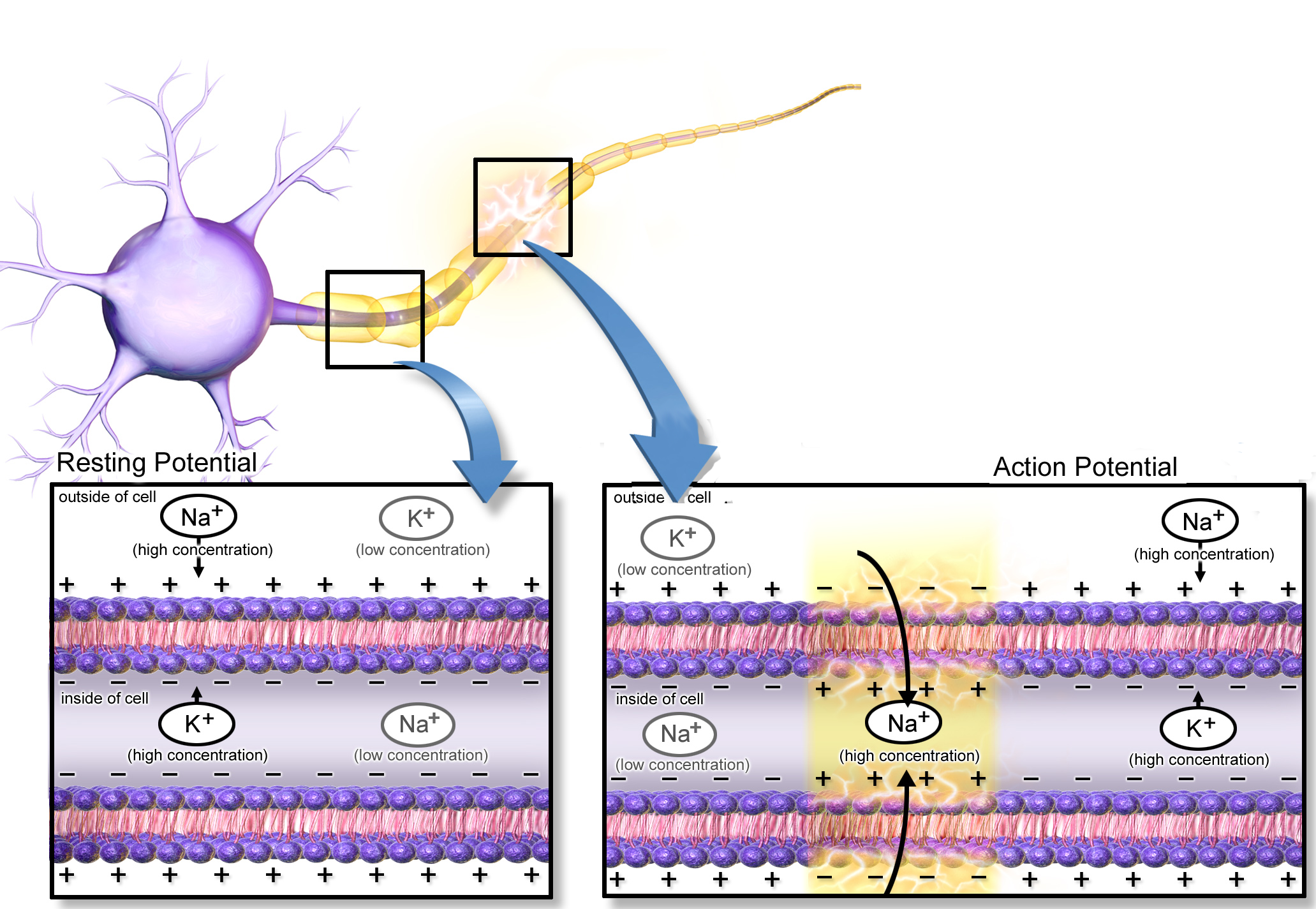
A két legelterjedtebb fényaktiválható ioncsatorna, a channelrhodopsin (ChR), illetve halorhodopszin (NpHR) egy Chlamydomonas reinhardtii nevű zöldalgából, illetve egy Natronobacterium pharaonsis nevű extremofil baktériumból származik. Előbbin pozitív ionok juthatnak át, míg utóbbin negatívak.
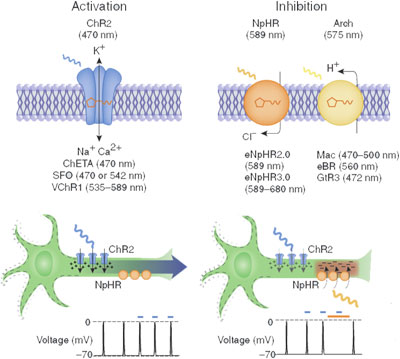
pozitív ionok áramlanak át, ezzel mesterséges akciós potenciál generálható. A halorhodopszin csatornákon átáramló negtív ionok viszont képesek ezt meggátolni (forrás: OpenWetWare).
Ráadásul más-más hullámhosszú fény aktiválja őket, aminek következtében tökéletesen kiegészítik egymást: egyetlen sejtben párhuzamosan kifejezve lehetővé tesszik, hogy kedvünkre ki-be kapcsolgathassuk az adott idegsejt aktivitását, mesterséges akciós potenciálokat generálva, illetve azokat elnyomva.
Persze az elején nem volt triviális, hogy egy alga fehérje egy emlős idegsejtben hibátlanul fog működni, ezért is annyira fontos az a tíz évvel ezelőtti Nature Neuroscience cikk, amelyben a Karl Deisseroth stanfordi laborjában dolgozó Ed Boyden, és az azóta a CRISPR-alapú genomszerkesztéssel is befutó Feng Zhang bebizonyították, hogy a ChR segítségével tényleg aktiválható egy idegsejt.
Azóta már rengeteg kísérletben használták ezeket a fehérjéket, gyakran lenyűgöző eredménnyel. A Nature egyik tavasszal publikált tanulmányában például olyan idegsejtekben fejeztették ki a ChR-t, amelyekről gyanították, hogy a szomjúságérzet kialakításában játszanak szerepet. Az alábbi videón is látható eredmény tökéletesen mutatja, milyen fantasztikus potenciál van ebben a technológiában: a valójában egyáltalán nem szomjas patkány azonnal, kényszeresen lefetyelni kezd, amikor a kutatók "bekapcsolják" ezt az agyi területet.
Persze azért az optogenetikában sem minden fenékig tejfel és ha jobban megnézzük, van számos olyan jelenség, ami miatt nehezebb a kísérletek értelmezése: a ChR és NpHR puszta kifejeződése is beleszólhat az idegsejt nyugalmi működésébe, változó lehet hogy szomszédos idegsejtek mennyire fejezik ki ezeket a mesterségesen bevitt fehérjéket, nem is szólva a fény bejuttatásához szükséges implantátumok potenciális mellékhatásairól.
És ha mindez nem lenne elég, a napokban egy magyar számazású kutató újabb bizonyítékkal állt elő, hogy az optogenetikai kísérletek értelmezése sokkal bonyolultabb, mint azt eddig sejtettük. A Harvard Egyetemen dolgozó Ölveczky Bence patkányokon és zebrapintyeken mutatta ki, hogy a tranziensnek szánt optogenetikai beavatkozások számos nem várt következménnyel járhatnak, mert megzavarhatják az egész agy működését és a beavatkozást követő viselkedésváltozás felületes értelmezése, akár teljesen félrevezethet. Hogy jobban megértsük, miről is van szó, egy villáminterjúval támadtam le Bencét.

1. Az alapkoncepció nagyon egyszerűnek látszik: ha a rendelkezésünkre álló optogenetikai eszközökkel kikapcsolunk egy agyi területet és egy viselkedésben változást látunk, akkor abból levonható a következtetés, hogy a szóbanforgó idegsejtek az adott viselkedést befolyásolják. Mikor érezted úgy először, hogy ez a "paraszti logika" hibás?
Kísérleteinkben először gyógyszereket használtunk az idegsejtek átmeneti "kikapcsolására", konkrétabban egy muscimol nevű GABA-agonistát (szerk.: ez a légyölő galóca legfontosabb hatóanyaga is, ami fontos gátló receptorokat aktivál). Ezzel az "elvárt" eredményt kaptuk, hogy a mozgatókéregnek szerepe van az általunk vizsgált mozgásokban. Mivel ez volt a kiindulási hipotézisünk, így örültünk ennek. De az egyik nap félrement valami a gyógyszer bejuttatása közben és attól tartottam, hogy az agyszövet megsérült. Azonban ahelyett, hogy kidobtuk volna a kísérletet, elhatároztuk, hogy egy nagyobb léziót csinálunk a mozgatókéregben, hogy ezzel is bebizonyítsuk a fontosságát a vizsgált viselkedésben. Így persze ledöbbentem, amikor pár nap pihenés után a patkányok minden további nélkül végrehajtották a feladatot, pont mint a beavatkozás előtt. Egyből tudtam, hogy nem publikálhatjuk eredeti eredményeinket, mert félrevezetőek lehetnek. Ekkor végeztük el a gyógyszerkezelésekhez hasonló optogenetikai kísérleteket is. Nem túl meglepő módon ugyanazt az eredményt kaptunk, mint a gyógyszeres megközelítéssel. Vagyis az agyműködés vizsgálatára legyakrabban használt beavatkozások egyfajta eredményt adtak, a permanens léziók pedig egy másikat. Meg kellett valahogy magyaráznunk ezt az eltérést.
Ez egyben jól jelzi, mi a "veszélye" az átmeneti beavatkozásoknak. Gyakran az előítéleteink beigazolására használjuk őket és azt az eredményt hozzák, amit (el)várunk. A mi esetünkben mindenképpen. A legtöbben azért bolygatunk meg bizonyos idegi hálózatokat, mert azt gondoljuk, hogy az agy adott része fontos egy viselkedéshez, és amikor úgy érzed, hogy a hipotézised beigazolódott, nem vizsgálod tovább a problémát mélyebben.
2. Felületesen olvasva elsőre paradoxnak tűnhet, hogy egy optogenetikai (vagy gyógyszeres) precíz és ideiglenes beavatkozás durvább hatásokkal jár a viselkedésben, mint egy permanens károsodás/lézió. Hogy lehet ez?
Azért van ez, mert az agy egy finoman hangolt, dinamikus rendszer, aminek szűkös a mozgástere. Ha hirtelen valahol megbolygatsz egy ilyen rendszert, akkor átmeneti hatásokat fogsz észelni a rendszer távoli pontjain is. Ez azt jelenti, hogy a viselkedésbeli hatások, amiket ilyen beavatkozásoknál kapsz, nem csak a megcélzott hálozat funkcióját tükrözik, hanem olyan távoli hálózatokét is, amelyek közvetett, vagy közvetlen módon kapcsolódnak hozzá. Más szóval túlbecsülheted egy hálózat szerepét tranziens beavatkozásokkal. Az emberi társadalmak szintén sok dologtól függő, egymással kapcsolódó dinamikus rendszerek, akárcsak az agy. A következő analógia talán segíthet megmagyarázni ezt a látszólagos paradoxont: képzeljük el, hogy Budapest összes kamionosa egyszerre sztrájkolni kezdene. Az élelmiszerellátás fennakadásokkal küzdene, az éttermek vagy bezárnának, vagy rossz minőségű ételt szolgálnának fel. A kórházakba nem jutának el a gyógyszerek, ami miatt betegek halnának meg, stb. A sztrájk kezdetét követő napokban a város működése komoly zavarokat szenvedne. De idővel új szállítási formák jelennének meg (pl. vonatok, villamosok, buszok, hajók). Egy héttel később többé-kevésbé minden a régi kerékvágásban menne, bár a kamionosok még mindig sztrájkolnának. De ha téged az érdekel, hogy a gourmet éttermek miképpen készítik az ételeiket, a sztrájk első napjaiban arra a következtetésre juthattál volna, hogy a kamionosok pótolhatatlan részei a folyamatnak. A társadalomnak olyan a szerveződése, hogy a kamionosok segítenek, vagy lehetővé tesznek sok mindent, de nem esszenciálisak ezekhez. Amihez nélkülözhetetlenek, az a teherautók mozgatása az utakon. Ugyanígy működik az agy. Bizonyos hálózatok hirtelen megbolygatása kezdetben szerteágazó következményekkel járhat, mert beleszólnak más hálózatok működésébe is, de ezek a (mellék)hatások később minden további nélkül lecsengenek.
3. Hogyan kell elképzelni egy idegi hálózat homeosztatikus regulációját?
Ennek a szabályozástípusnak a legegyszerűbb formája, amiről egyben a legtöbbet is tudunk, az egyes idegsejtek szintjén történik: minden neuron figyeli a saját tüzelési gyakoriságát és ha ez lecsökken, vagy megnő - ami pl. egy bemenet végleges megszünésével együtt járhat -, a sejtek bizonyos fehérjéik (pl. ioncsatornák) szabályozásával elérik, hogy az átlagos tüzelési gyakoriságuk ismét a kívánt tartományban legyen. Az általunk végzett számítógépes szimulációk azt mutatják, hogy egy-egy sejt ingerküszöbének megváltozása elég ahhoz, hogy komplex hálózatok működése visszaálljon, ha korábban az egyik bemenetük megvonásával inaktiváltuk őket. Hogy léteznek-e komplexebb szabályai is a hálózatok homeosztatikus szabályozásának, az egy érdekes kérdés.
4. A cikketek végén egy félmondatos utalás van arra, hogy a zebrapintyes megfigyeléseitek az alvás szerepéről is fontos dolgokat árulhatnak el. Tudnál erről egy kicsit bővebben mesélni?
Az alvás elengedhetetlen az élethez, de hogy mi történik az agyunkkal alvás közben még mindig nem nagyon értjük. A mi eredményeink azt mutatják, hogy a hálózati dinamika sérülést követő visszaállása éjjel történik. Ez azt sugallja, hogy azok a folyamatok, amelyek lehetővé teszik, hogy a hálózat ismét ellássa a funkcióját, alvás közben következnek be. Másképp fogalmazva, az alvásnak jótékony hatása lehet, ami segíti az agy gyógyulását sérülés után.
